Analysis of clinical characteristics of malignant tumors complicated with venous thromboembolism and evaluation of predictive models
-
摘要:
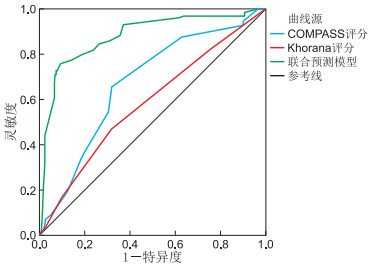
目的 探讨恶性肿瘤并发静脉血栓栓塞症(VTE)的临床特征, 验证COMPASS-CAT及Khorana评分的预测价值。 方法 收集2016年1月—2020年1月在蚌埠医学院第一附属医院住院确诊恶性肿瘤合并VTE的患者128例为VTE组,以同期年龄、性别及肿瘤类型相匹配的恶性肿瘤未合并VTE的患者256例为对照组。采用logistic回归模型分析发生VTE的风险因素。比较COMPASS-CAT及Khorana评分的预测价值,并尝试构建一种更为有效的预测模型来指导肿瘤患者的血栓预防。 结果 (1) D-二聚体>0.55 mg/L、中心静脉导管、心血管危险因素是肿瘤发生VTE的高风险因素(均P < 0.05)。(2)COMPASS-CAT评分≥7分在VTE组与对照组中的占比差异有统计学意义(P < 0.001)。COMPASS-CAT评分为高风险患者发生VTE的几率是低风险患者的4.051倍。Khorana评分≥3分在VTE组与对照组中的占比差异无统计学意义(P>0.05)。COMPASS-CAT评分的ROC曲线下面积(AUC)高于Khorana评分(AUC:0.670 vs. 0.583,P < 0.05)。(3)在COMPASS-CAT评分的基础上纳入D-二聚体>3.83 mg/L构建联合预测模型,其AUC为0.879,与COMPASS-CAT评分相比,联合预测模型的AUC增加了0.209,差异有统计学意义(P < 0.001)。 结论 COMPASS-CAT评分能较好地预测肿瘤患者发生VTE的风险,而Khorana评分预测价值有限。将COMPASS-CAT评分和D-二聚体>3.83 mg/L联合构建新预测模型可提高肿瘤相关VTE的预测效能。 -
关键词:
- 恶性肿瘤 /
- 静脉血栓栓塞 /
- Khorana评分 /
- COMPASS-CAT评分
Abstract:Objective The aim of this study was to investigate the clinical characteristics of malignant tumors complicated with venous thromboembolism (VTE) and verify the predictive value of COMPASS-CAT and Khorana score. Methods A total of 128 patients who were diagnosed with malignant tumors and VTE in the First Affiliated Hospital of Bengbu Medical College from January 2016 to January 2020 were collected as the VTE group, and a total of 256 patients with malignant tumor without VTE matched by age, sex and tumor type were selected as the control group. Logistic regression model was used to analyze the risk factors of VTE. The predictive value of COMPASS-CAT and Khorana risk score (KRS) for venous thromboembolism in cancer patients was compared, to construct a more effective predictive model to guide thrombosis prevention in patients with malignant tumors. Results (1) D-dimer>0.55 mg/L, central venous catheter, and cardiovascular risk factors were high risk factors for VTE in patients with malignant tumors (P values were less than 0.05). (2) The proportion of COMPASS-CAT score≥7 was statistically significant between the VTE group and the control group (P < 0.001). The probability was 4.051 times higher in high risk patients than in low risk patients by COMPASS-CAT score. There was no statistically significant difference in the proportion of Khorana score≥3 points in the VTE group and the control group (P>0.05). The area under ROC curve (AUC) of COMPASS-CAT score was higher than that of Khorana score (AUC: 0.670 vs. 0.583, P < 0.05). (3) On the basis of COMPASS-CAT score, including D-dimer>3.83 mg/L to a joint prediction model was constructed, its AUC was 0.879. Compared with the COMPASS-CAT score, the AUC of the joint prediction model increased by 0.209, and the difference was statistically significant (P < 0.001). Conclusion The COMPASS-CAT score can better predict the risk of VTE in patients with malignant tumors, while the KRS has limited predictive value. Combining COMPASS-CAT score and D-dimer>3.83 mg/L to construct a new prediction model can improve the prediction performance of malignant tumor-related VTE. -
Key words:
- Malignant tumor /
- Venous thromboembolism /
- Khorana risk score /
- COMPASS-CAT score
-
表 1 VTE组和对照组恶性肿瘤患者的临床资料比较[例(%)]
组别 例数 晚期癌症 癌症确诊时间(≤6个月) 因急性内科疾病住院 心血管危险因素 缺血性脑卒中 冠状动脉疾病 高血压 高脂血症 VTE组 128 100(78.1) 99(77.3) 6(4.7) 44(34.4) 11(8.6) 9(7.0) 38(29.7) 60(46.9) 对照组 256 148(57.8) 216(84.4) 6(2.3) 35(13.7) 18(7.0) 4(1.6) 45(17.6) 131(51.2) χ2值 15.393 2.862 0.871 22.383 0.298 6.220 7.386 0.630 P值 < 0.001 0.091 0.351 < 0.001 0.585 0.013 0.007 0.427 组别 例数 感染 糖尿病 VTE史 中心静脉导管 血小板≥350×109/L 白细胞>11×109/L 血红蛋白 < 100 g/L D-二聚体>0.55 mg/L VTE组 128 19(14.8) 15(11.7) 13(10.2) 23(18.0) 25(19.5) 29(22.7) 38(29.7) 122(95.3) 对照组 256 19(7.4) 21(8.2) 0(0.0) 24(9.4) 21(8.2) 37(14.5) 41(16.0) 160(62.5) χ2值 5.272 1.241 23.896 5.867 10.385 4.034 9.761 47.099 P值 0.022 0.265 < 0.001 0.015 0.001 0.045 0.002 < 0.001 注:心血管危险因素是指由以下至少2项预测因素组成,缺血性脑卒中、冠状动脉疾病、高血压、高脂血症、糖尿病、肥胖症的个人病史。 表 2 VTE危险因素的多因素logistic回归分析
项目 B SE Wald χ2 P值 OR(95% CI) D-二聚体>0.55 mg/L 2.299 0.497 21.414 < 0.001 9.966(3.764~26.391) 中心静脉导管 0.772 0.370 4.358 0.037 2.164(1.048~4.469) 心血管危险因素 1.267 0.395 10.272 0.001 3.552(1.636~7.710) 注:以晚期癌症、存在心血管危险因素、冠状动脉疾病、高血压、感染、VTE史、中心静脉导管、血小板≥350×109/L、血红蛋白 < 100 g/L、白细胞>11×109/L、D-二聚体>0.55 mg/L为自变量,当上述某个自变量存在时,则该自变量赋值为1,若不存在,则赋值为0;以是否发生VTE为因变量,其中发生VTE赋值为1,未发生VTE赋值为0。 表 3 COMPASS-CAT及Khorana评分的比较[例(%)]
组别 例数 COMPASS-CAT评分 Khorana评分 高风险(≥7分) 低风险(<7分) 高风险(≥3分) 低风险(<3分) VTE组 128 84(65.6) 44(34.4) 21(16.4) 107(83.6) 对照组 256 82(32.0) 174(68.0) 25(9.8) 231(90.2) χ2值 39.240 3.569 P值 < 0.001 0.059 -
[1] HEIT J A, SILVERSTEIN M D, MOHR D N, et al. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study[J]. Arch Intern Med, 2000, 160(6): 809-815. doi: 10.1001/archinte.160.6.809 [2] CHEW H K, WUN T, HARVEY D J, et al. Incidence of venous thromboembolism and the impact on survival in breast cancer patients[J]. J Clin Oncol, 2007, 25(1): 70-76. http://hwmaint.jco.ascopubs.org/cgi/reprint/25/1/70.pdf [3] MARTINO M A, WILLIAMSON E, SIEGFRIED S, et al. Diagnosing pulmonary embolism: experience with spiral CT pulmonary angiography in gynecologic oncology[J]. Gynecol Oncol, 2005, 98(2): 289-293. doi: 10.1016/j.ygyno.2005.04.020 [4] MANSFIELD A S, TAFUR A J, WANG C E, et al. Predictors of active cancer thromboembolic outcomes: validation of the Khorana score among patients with lung cancer[J]. J Thromb Haemost, 2016, 14(9): 1773-1778. doi: 10.1111/jth.13378 [5] RUPA-MATYSEK J, GIL L, KAZMIERCZAK M, et al. Prediction of venous thromboembolism in newly diagnosed patients treated for lymphoid malignancies: validation of the Khorana Risk Score[J]. Med Oncol, 2017, 35(1): 5. doi: 10.1007%2Fs12032-017-1065-4.pdf [6] VAN ES N, DI NISIO M, CESARMAN G, et al. Comparison of risk prediction scores for venous thromboembolism in cancer patients: a prospective cohort study[J]. Haematologica, 2017, 102(9): 1494-1501. doi: 10.3324/haematol.2017.169060 [7] VAN ES N, FRANKE VF, MIDDELDORP S, et al. The Khorana score for the prediction of venous thromboembolism in patients with pancreatic cancer[J]. Thromb Res, 2017, 150: 30-32. doi: 10.1016/j.thromres.2016.12.013 [8] GEROTZIAFAS G T, TAHER A, ABDEL-RAZEQ H, et al. A predictive score for thrombosis associated with breast, colorectal, lung, or ovarian cancer: the prospective compass-cancer-associated thrombosis study[J]. Oncologist, 2017, 22: 1222-1231. doi: 10.1634/theoncologist.2016-0414 [9] 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. doi: 10.3760/cma.j.issn.0376-2491.2018.14.007 [10] 中华医学会外科学分会血管外科学组. 深静脉血栓形成的诊断和治疗指南(第三版)[J]. 中华普通外科杂志, 2017, 32(9): 807-812. doi: 10.3760/cma.j.issn.1007-631X.2017.09.032 [11] KHORANA A A, KUDERER N M, CULAKOVA E, et al. Development and validation of a predictive model for chemotherapy-associated thrombosis[J]. Blood, 2008, 111: 4902-4907. doi: 10.1182/blood-2007-10-116327 [12] RUBIO-JURADO B, BALDERAS-PENA L M, GARCIA-LUNA E E, et al. Obesity, thrombotic risk, and inflammation in cancer[J]. Adv Clin Chem, 2018, 85: 71-89. http://www.onacademic.com/detail/journal_1000040809216510_e6e2.html [13] KIM M S, CHANG H, LEE S Y, et al. Differential clinical manifestations and clinical outcome of cancer-related pulmonary embolism[J]. Korean J Intern Med, 2020, 35(2): 360-368. doi: 10.3904/kjim.2018.267 [14] 谭政, 许小毛, 杨菁菁, 等. 消化系统恶性肿瘤合并静脉血栓患者的临床特点及预后分析[J]. 中华老年医学杂志, 2017, 36(10): 1075-1079. doi: 10.3760/cma.j.issn.0254-9026.2017.10.005 [15] BOERSMA R S, HAMULYAK K, VAN OERLE R, et al. Biomarkers for prediction of central venous catheter related-thrombosis in patients with hematological malignancies[J]. Clin Appl Thromb Hemost, 2016, 22(8): 779-784. doi: 10.1177/1076029615579098 [16] LYMAN G H, CULAKOVA E, PONIEWIERSKI M S, et al. Morbidity, mortality and costs associated with venous thromboembolism in hospitalized patients with cancer[J]. Thromb Res, 2018, 164 (Suppl 1): S112-s118. [17] 洪都, 徐军, 颜勇卿, 等. Wells评分联合D-二聚体对疑似急性肺栓塞患者的诊断价值[J]. 中华全科医学, 2019, 17(4): 538-542, 613. https://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201904005.htm [18] ROSENBERG D, EICHORN A, ALARCON M, et al. External validation of the risk assessment model of the international medical prevention registry on venous thromboembolism (IMPROVE) for medical patients in a tertiary health system[J]. J Am Heart Assoc, 2014, 3(6): e001152. http://europepmc.org/abstract/MED/25404191 [19] SPYROPOULOS A C, ELDREDGE J B, ANAND L N, et al. External validation of a venous thromboembolic risk score for cancer outpatients with solid tumors: the COMPASS-CAT venous thromboembolism risk assessment model[J]. Oncologist, 2020, 25(7): e1083-e1090. doi: 10.1634/theoncologist.2019-0482 [20] HIRAIDE M, SHIGA T, MINOWA Y, et al. Identification of risk factors for venous thromboembolism and evaluation of Khorana venous thromboembolism risk assessment in Japanese lung cancer patients[J]. J Cardiol, 2020, 75(1): 110-114. doi: 10.1016/j.jjcc.2019.06.013 [21] AY C, DUNKLER D, MAROSI C, et al. Prediction of venous thromboembolism in cancer patients[J]. Blood, 2010, 116(24): 5377-5382. doi: 10.1182/blood-2010-02-270116 -




 下载:
下载: