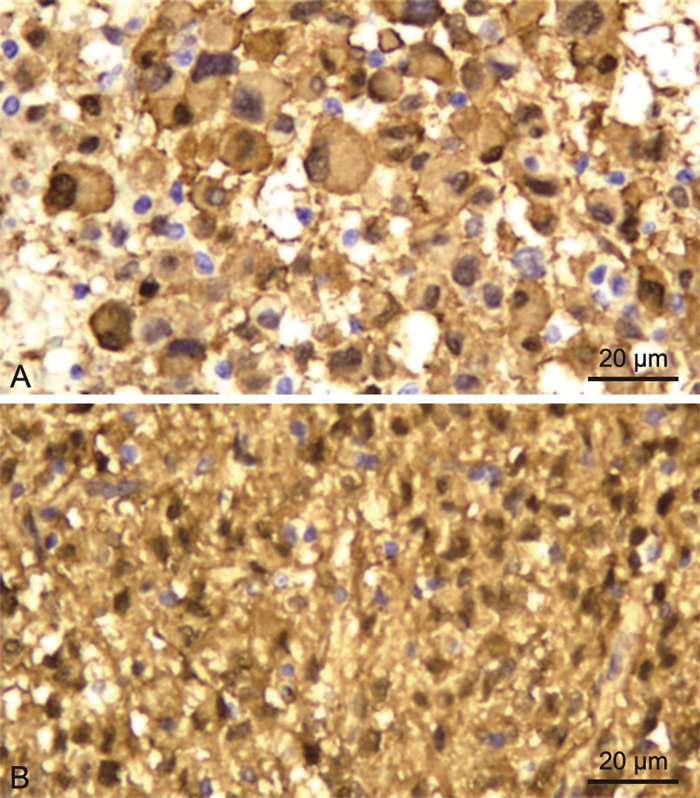
Expression and significance of annexin A1 and S100A16 protein in human glioma
-
摘要:
目的 探讨膜联蛋白A1(ANXA1)和S100A16蛋白在脑胶质瘤组织中的表达水平及其意义。 方法 收集广东祈福医院和南部战区总医院在2015年1月—2020年12月确诊的160例胶质瘤病例以及20例胚胎发育不良性神经上皮肿瘤(DNT)病例, 用免疫组化(IHC)方法检测ANXA1和S100A16蛋白的表达水平。 结果 ANXA1在胶质瘤组阳性率为80.6%(129/160),高于正常脑组织阳性率(7.5%,12/160)。S100A16在胶质瘤组阳性率为86.3%(138/160),高于正常脑组织组阳性率(10.0%,19/160)。ANXA1和S100A16在WHO分级Ⅰ~Ⅳ级胶质瘤中的阳性率差异无统计学意义。ANXA1在不包含WHO Ⅰ级的星形细胞来源肿瘤中的阳性率最高,达到95.0%(76/80),远比少突胶质细胞瘤中阳性率(42.9%,15/35)高。S100A16在不包含WHO Ⅰ级的星形细胞来源肿瘤中的阳性率(83.8%,67/80)与在少突胶质细胞瘤中阳性率(88.6%,31/35)比较差异无统计学意义。ANXA1在DNT组阳性率(100.0%,20/20)高于低级别胶质瘤组(78.8%,63/80)且差异有统计学意义。 结论 ANXA1可用于胶质瘤的辅助诊断标记,也可用于复杂型DNT与少突胶质细胞瘤的鉴别诊断,有一定的临床辅助诊断价值。S100A16的表达在胶质瘤中与正常脑组织之间差异有统计学意义,但不能作为辅助标记物用于DNT与低级别胶质瘤的鉴别诊断。 -
关键词:
- 胶质瘤 /
- 胚胎发育不良性神经上皮肿瘤 /
- 膜联蛋白A1 /
- S100A16 /
- 免疫组织化学
Abstract:Objective To investigate the expression level and significance of annexin A1 (ANXA1) and S100A16 protein in glioma. Methods A total of 160 glioma cases and 20 dysembryoplastic neuroepithelial tumor (DNT) cases confirmed by Guangdong Clifford Hospital and General Hospital of Southern Theater Command from January 2015 to December 2020 were collected. The expression levels of ANXA1 and S100A16 proteins were detected by immunohistochemistry (IHC). Results The detectable rate of ANXA1 in glioma group was 80.6% (129/160), which was higher than that in normal brain tissue by 7.5% (12/160). The detectable rate of S100A16 in the glioma group was 86.3% (138/160), which was higher than that in the normal brain tissue group by 10.0% (19/160). No significant difference in the detectable rates of ANXA1 and S100A16 was found in the WHO grade Ⅰ-Ⅳ gliomas. The detectable rate of annexin A1 in astrocytoma without WHO grade Ⅰ was the highest, reaching 95.0% (76/80), which was much higher than that in oligodendroglioma (42.9%, 15/35). The detectable rate of S100A16 in astrocytoma without WHO grade Ⅰ (83.8%, 67/80) was not statistically significant compared with that in oligodendroglioma (88.6%, 31/35). Significant difference in the detectable rate of ANXA1 was found between the DNT group (100.0%, 20/20) and low-grade glioma group (78.8%, 63/80). Conclusion ANXA1 can be used as an auxiliary diagnostic marker for glioma and for the differential diagnosis of complex DNT and oligodendroglioma. Statisical difference in the expression of S100A16 differed between glioma and normal brain tissue, but S100A16 cannot be used as an auxiliary marker in the differential diagnosis of DNT and low-grade glioma. -
Key words:
- Glioma /
- Dysembryoplastic neuroepithelial tumour /
- Annexin A1 /
- S100A16 /
- Immunohistochemistry
-
表 1 2组ANXA1表达情况比较
Table 1. Expression of ANXA1 in the two groups
组别 例数 -(例) +(例) ++(例) +++(例) 阳性率(%) 胶质瘤组 160 31 35 72 22 80.6(129/160) 正常对照组 160 148 5 5 2 7.5(12/160) 注:2组ANXA1阳性率比较,χ2=173.560,P < 0.001。 表 2 2组S100A16表达情况比较
Table 2. Expression of S100A16 in the two groups
组别 例数 -(例) +(例) ++(例) +++(例) 阳性率(%) 胶质瘤组 160 22 32 63 43 86.3(138/160) 正常对照组 160 141 10 8 1 10.0(19/160) 注:2组S100A16阳性率比较,χ2=177.075,P < 0.001。 表 3 不同WHO分级胶质瘤组织中ANXA1表达情况比较
Table 3. Comparison of ANXA1 expression in glioma tissues with different WHO grades
组别 例数 阳性(例) 阴性(例) 阳性率(%) WHO Ⅰ级 40 31 9 77.5 WHO Ⅱ级 40 32 8 80.0 WHO Ⅲ级 40 32 8 80.0 WHO Ⅳ级 40 34 6 85.0 合计 160 129 31 80.6 注:各组ANXA1阳性率比较,χ2=0.760,P=0.859。 表 4 不同WHO分级胶质瘤组织中S100A16表达情况比较
Table 4. Comparison of S100A16 expression in glioma tissues with different WHO grades
组别 例数 阳性(例) 阴性(例) 阳性率(%) WHO Ⅰ级 40 33 7 82.5 WHO Ⅱ级 40 34 6 85.0 WHO Ⅲ级 40 35 5 87.5 WHO Ⅳ级 40 36 4 90.0 合计 160 138 22 86.3 注:各组S100A16阳性率比较,χ2=1.054,P=0.788。 表 5 低级别胶质瘤组与DNT组ANXA1阳性率比较
Table 5. Comparison of ANXA1 positive rate between low-grade glioma group and DNT group
组别 合计 阳性(例) 阴性(例) 阳性率(%) 低级别胶质瘤组 80 63 17 78.8 DNT组 20 20 0 100.0 合计 100 83 17 83.0 注:2组ANXA1阳性率比较,χ2=5.120,P=0.024。 表 6 低级别胶质瘤组与DNT组S100A16阳性率比较
Table 6. Comparison of S100A16 positive rate between low-grade glioma group and DNT group
组别 合计 阳性(例) 阴性(例) 阳性率(%) 低级别胶质瘤组 80 67 13 83.8 DNT组 20 18 2 90.0 合计 100 85 15 85.0 注:2组S100A16阳性率比较,χ2=0.490,P=0.484。 -
[1] 刘征, 徐国政. 胶质瘤相关循环生物标志物的研究进展[J]. 中国临床神经外科杂志, 2017, 22(3): 201-203. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC201703030.htmLIU Z, XU G Z. Research progress of circulating biomarkers associated with glioma[J]. Chinese Journal of Clinical Neurosurgery, 2017(3): 201-203. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC201703030.htm [2] LI Y, ALI S, CLARKE J, et al. Bevacizumab in recurrent glioma: Patterns of treatment failure and implications[J]. Brain Tumor Res Treat, 2017, 5(1): 1-9. doi: 10.14791/btrt.2017.5.1.1 [3] 翁一鸣, 胡伟国, 宋启斌. 成人低级别胶质瘤术后治疗研究进展[J]. 肿瘤学杂志, 2017, 23(1): 60-64. doi: 10.3760/cma.j.issn.1673-422X.2017.01.016WEN Y M, HU W G, SONG Q B. Progess of postoperative treatment for adult low grade glioma[J]. Journal of Chinese Oncology, 2017, 23(1): 60-64. doi: 10.3760/cma.j.issn.1673-422X.2017.01.016 [4] 陈晓东, 廖秋林, 张伟, 等. 应用iTRAQ技术筛选DNT与低级别胶质瘤差异表达蛋白[J]. 中华全科医学, 2016, 14(7): 1077-1079, 1089. doi: 10.16766/j.cnki.issn.1674-4152.2016.07.005CHEN X D, LIAO Q L, ZHANG W, et al. iTRAQ technology for differentially expressed proteins screening in dysembryoplastic neuroepithelial tumor and low grade glioma[J]. Chinese Journal of General Practice, 2016, 14(7): 1077-1079, 1089. doi: 10.16766/j.cnki.issn.1674-4152.2016.07.005 [5] 王涛, 白培德, 谢顺强, 等. 膜联蛋白A1调控膀胱癌细胞增殖、凋亡及迁移的机制[J]. 中华泌尿外科杂志, 2019, 40(12): 932-936. doi: 10.3760/cma.j.issn.1000-6702.2019.12.012WANG T, BAI P D, XIE S Q, et al. The mechanism of Annexin A1 regulating the proliferation, apoptosis and migration of bladder cancer cells[J]. Chinese Journal of Urology, 2019, 40(12): 932-936. doi: 10.3760/cma.j.issn.1000-6702.2019.12.012 [6] 江若霞, 赵丽敏. 膜联蛋白A1基因的表达与胆囊癌临床病理的关系及调控信号转导与转录因子3信号通路对胆囊癌细胞增殖凋亡的影响[J]. 安徽医药, 2018, 22(6): 1082-1087. doi: 10.3969/j.issn.1009-6469.2018.06.020JIANG R X, ZHAO L M. The relationship between the expression of ANXA1 gene and the clinical pathology of gallbladder carcinoma and the effect of STAT3 signaling pathway on the proliferation and apoptosis of gallbladder cancer cells[J]. Anhui Medical and Pharmaceutical Journal, 2018, 22(6): 1082-1087. doi: 10.3969/j.issn.1009-6469.2018.06.020 [7] TU Y, JOHNSTONE C N, STEWART A G. Annexin A1 influences in breast cancer: Controversies on contributions to tumour, host and immunoediting processes[J]. Pharmacol Res, 2017, 119: 278-288. doi: 10.1016/j.phrs.2017.02.011 [8] MORAES L A, KAR S, FOO S L, et al. Annexin-A1 enhances breast cancer growth and migration by promoting alternative macrophage polarization in the tumour microenvironment[J]. Sci Rep, 2017, 7: 17925. DOI: 10.1038/s41598-017-17622-5. [9] 陈晓, 魏立, 务森, 等. 膜联蛋白A1在食管癌组织的表达及其临床意义[J]. 中华实验外科杂志, 2017, 34(8): 1339-1341. doi: 10.3760/cma.j.issn.1001-9030.2017.08.024CHEN X, WEI L, WU S, et al. Expression of annexin A1 protein in esophageal carcinoma and its clinical significance[J]. Chinese Journal of Experimental Surgery, 2017, 34(8): 1339-1341. doi: 10.3760/cma.j.issn.1001-9030.2017.08.024 [10] 黄鑫, 陈博, 李自康, 等. 不同放化疗敏感性食管鳞状细胞癌中膜联蛋白A1的表达及预后因素分析[J]. 蚌埠医学院学报, 2019, 44(10): 1344-1348. https://www.cnki.com.cn/Article/CJFDTOTAL-BANG201910016.htmHUANG X, CHEN B, LI Z K, et al. Expression of annexin A1 in ESCC with different chemoradiotherapy sensitivity and prognostic factors of ESCC[J]. Journal of Bengbu Medical College, 2019, 44(10): 1344-1348. https://www.cnki.com.cn/Article/CJFDTOTAL-BANG201910016.htm [11] 赖文芳, 黄鑫, 刘俊杰, 等. 片仔癀调控膜联蛋白A1/VEGF通路对人肝癌细胞系HepG2作用的影响[J]. 中国药理学通报, 2019, 35(11): 1534-1538. https://www.cnki.com.cn/Article/CJFDTOTAL-YAOL201911012.htmLAI W F, HUAGN X, LIU J J, et al. Pien Tze Huang promotes HepG2 apoptosis via regulating ANXA1/VEGF signaling pathway[J]. Chinese Pharmacological Bulletin, 2019, 35(11): 1534-1538. https://www.cnki.com.cn/Article/CJFDTOTAL-YAOL201911012.htm [12] FOO S L, YAP G, CUI J, et al. Annexin-A1-A blessing or a curse in cancer[J]. Trends Mol Med, 2019, 25: 315-327. [13] 蔡艳星, 刘烨, 杨洪芬. 膜联蛋白及其与胶质瘤关系的研究进展[J]. 解放军医药杂志, 2017, 29(8): 112-116. https://www.cnki.com.cn/Article/CJFDTOTAL-HBGF201708029.htmCAI Y X, LIU Y, YANG H F. Advances in annexin and its relationship with glioma[J]. Medical & Pharmaceutical Journal of Chinese People ' s Liberation Army, 2017, 29(8): 112-116. https://www.cnki.com.cn/Article/CJFDTOTAL-HBGF201708029.htm [14] 李永明, 李海洋, 赵亚军, 等. 膜联蛋白A2调控人脑胶质瘤细胞侵袭迁移的研究[J]. 中华实验外科杂志, 2018, 35(3): 471-474.LI Y M, LI H Y, ZHAO Y J, et al. Regulatory effect of annexin A2 on invasion and migration of human glioma cells[J]. Chinese Journal of Experimental Surgery, 2018, 35(3): 471-474. [15] 李璐, 奚玲, 薛一, 等. S100A16在前列腺癌中的表达及促进前列腺癌细胞侵袭的分子机制[J]. 东南大学学报(医学版), 2015, 34(1): 1-7. https://www.cnki.com.cn/Article/CJFDTOTAL-NJTD201501001.htmLI L, XI L, XUE Y, et al. Expression of S100A16 in prostate cancer and the effects and mechanisms of S100A16 on human prostate cancer cells[J]. Journal of Southeast University(Medical Science Edition), 2015, 34(1): 1-7. https://www.cnki.com.cn/Article/CJFDTOTAL-NJTD201501001.htm [16] MEDKOVA A, SROVNAL J, POTOMKOVA J, et al. Multifarious diagnostic possibilities of the S100 protein family: Predominantly in pediatrics and neonatology[J]. World J Pediatr, 2018, 14: 315-321. -
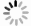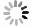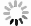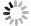




 下载:
下载: