Clinical significance of lymphocyte-monocyte ratio in the prognosis of elderly patients undergoing curative chemoradiotherapy for esophageal cancer
-
摘要:
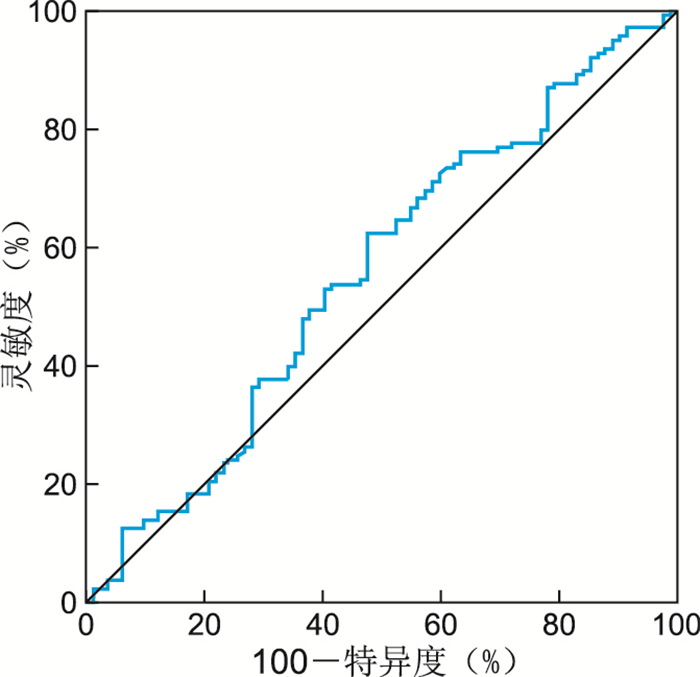
目的 分析根治性放化疗前淋巴细胞-单核细胞比值(lymphocyte-to-monocyte ratio, LMR)对老年食管癌(esophagus cancer,EC)患者预后的评估价值。 方法 收集2014年1月—2017年12月在蚌埠医学院第一附属医院放射肿瘤科接受EC根治性放化疗的老年(≥65岁)患者220例,回顾性分析所纳入患者的临床数据及实验室检验指标。通过建立受试者工作特征曲线,约登指数最大值时的LMR为4.9,将LMR=4.9作为临界值,分为高LMR组(>4.9,69例)和低LMR组(≤4.9,151例),通过Kaplan-Meier方法绘制2组患者的生存曲线,采用Log Rank法比较2组患者的生存状况,通过Cox回归模型进行多因素分析。 结果 全组共有82例患者生存,总体中位随访时间为45个月,总体中位生存时间为28个月。高LMR组和低LMR组患者的5年无进展生存率分别为38.6%和29.8%(P=0.005),5年总生存率分别为47.0%和26.5%(P=0.003)。Cox回归模型多因素分析结果显示,根治性放化疗前LMR值是老年EC患者预后的独立影响因素(HR=0.634,95% CI:0.422~0.954,P=0.029)。 结论 对于接受根治性放化疗的老年EC患者来说,根治性放化疗前LMR降低是独立不良预后因素。 -
关键词:
- 老年患者 /
- 食管癌 /
- 根治性放化疗 /
- 淋巴细胞-单核细胞比值 /
- 预后
Abstract:Objective To analyze the prognostic value of lymphocyte to monocyte ratio (LMR) in elderly patients with esophageal cancer (EC). Methods A total of 220 elderly (≥65 years) patients who underwent radical chemoradiotherapy for EC at the Radiation Oncology Department of the First Affiliated Hospital of Bengbu Medical College from January 2014 to December 2017 were enrolled, and the clinical data and laboratory test indexes of the included patients were retrospectively reviewed. By constructing receiver operating characteristic curve, the LMR at the maximum value of Youden index was 4.9, and LMR=4.9 was used as the cut-off value to divide the patients into high LMR group (>4.9, 69 cases) and low LMR group (≤4.9, 151 cases), the survival curves of the two groups were plotted by Kaplan-Meier method, log-rank method to compare the survival status of the two groups, and multivariate analysis was performed by Cox regression model. Results A total of 82 patients were alive in the whole group with a median overall follow-up of 45 months and a median overall survival time of 28 months. The 5-year progression-free survival rates of patients in the high and low LMR groups before radical chemoradiotherapy were 38.6% and 29.8%, respectively (P=0.005), and the 5-year overall survival rates were 47.0% and 26.5%, respectively (P=0.003). By Cox regression model multivariate analysis, the results showed that LMR value before radical chemoradiotherapy was an independent factor affecting the prognosis of elderly EC patients (HR=0.634, 95% CI: 0.422-0.954, P=0.029). Conclusion In elderly EC patients receiving radical chemoradiotherapy, reduced LMR prior to radical chemoradiotherapy was an independent adverse prognostic factor. -
Key words:
- Elderly patients /
- Esophageal cancer /
- Radiotherapy /
- Lymphocyte-to-monocyte ratio /
- Prognosis
-
表 1 高LMR组和低LMR组患者的一般临床资料比较(例)
Table 1. Comparison of general clinical characteristics between patients in the high LMR group and low LMR group (cases)
因素 高LMR组(n=69) 低LMR组(n=151) 统计量 P值 性别 2.485a 0.149 男性 44 112 女性 25 39 肿瘤位置 1.375b 0.711 颈段 5 6 胸上段 20 49 胸中段 26 53 胸下段 18 43 肿瘤分期 -1.181b 0.238 Ⅰ期 24 37 Ⅱ期 29 76 Ⅲ期 16 38 病理类型 0.247a 0.619 鳞癌 65 146 腺癌 4 5 饮酒 0.091a 0.837 是 9 22 否 60 129 放疗剂量 0.119a 0.772 高剂量 33 76 低剂量 36 75 注:a为χ2值,b为Z值。 表 2 影响老年食管癌放疗患者预后的单因素分析
Table 2. Univariate analysis of prognostic factors in elderly patients with esophageal cancer undergoing radiotherapy
项目 例数 中位生存时间(月) χ2值 P值 中位无进展时间(月) χ2值 P值 性别 男性 156 29.0(23.5~34.5) 1.366 0.243 21.0(16.7~25.3) 2.023 0.037 女性 64 28.0(8.3~47.7) 25.0(7.7~42.3) 肿瘤分期 Ⅰ期 61 43.0(31.5~54.5) 8.688 0.013 29.0(23.3~34.7) 9.749 0.070 Ⅱ期 105 30.0(21.8~38.2) 22.0(14.5~29.5) Ⅲ期 54 17.0(12.0~22.0) 11.0(7.0~15.0) 病理类型 鳞癌 211 29.0(23.9~34.1) 0.036 0.850 22.0(18.4~25.6) 0.002 0.824 腺癌 9 21.0(3.7~38.5) 19.0(4.4~33.6) 放疗前LMR ≤4.9 151 24.0(18.6~29.4) 8.640 0.003 20.0(16.9~23.1) 7.925 0.005 >4.9 69 56.0(25.2~70.0) 45.0(20.1~70.0) 肿瘤部位 颈段 11 43.0(19.2~66.8) 4.818 0.186 30.0(9.5~50.5) 4.189 0.348 胸上段 69 33.0(11.0~55.0) 25.0(16.9~33.1) 胸中段 79 32.0(24.2~39.8) 23.0(13.3~32.7) 胸下段 61 22.0(17.7~26.3) 19.0(14.6~23.4) 放疗剂量 高剂量 109 30.0(22.3~37.7) 0.017 0.896 22.0(18.6~25.4) 0.004 0.799 低剂量 111 28.0(19.3~36.7) 23.0(17.8~28.2) 表 3 影响老年食管癌放疗患者预后的多因素分析
Table 3. Multivariable analysis of prognostic factors in elderly patients with esophageal cancer undergoing radiotherapy
项目 B SE Wald χ2 P值 HR值 95% CI 性别 -0.084 0.201 0.165 0.684 0.919 0.612~1.381 肿瘤分期 0.682 0.120 7.963 0.005 1.978 1.232~3.177 放疗前LMR -0.455 0.203 4.782 0.029 0.634 0.422~0.954 -
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660 [2] ALLEMANI C, MATSUDA T, DI CARLO V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. doi: 10.1016/S0140-6736(17)33326-3 [3] MALHOTRA G K, YANALA U, RAVIPATI A, et al. Global trends in esophageal cancer[J]. J Surg Oncol, 2017, 115(5): 564-579. doi: 10.1002/jso.24592 [4] CHEN M F, CHEN P T, LU M S, et al. Survival benefit of surgery to patients with esophageal squamous cell carcinoma[J]. Sci Rep, 2017, 7(4): 61-69. [5] ISHIBASHI Y, TSUJIMOTO H, HIRAKI S, et al. Prognostic value of preoperative systemic immunoinflammatory measures in patients with esophageal cancer[J]. Ann Surg Oncol, 2018, 25(11): 3288-3299. doi: 10.1245/s10434-018-6651-y [6] YODYING H, MATSUDA A, MIYASHITA M, et al. Prognostic significance of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in oncologic outcomes of esophageal cancer: a systematic review and meta-analysis[J]. Ann Surg Oncol, 2016, 23(2): 646-654. doi: 10.1245/s10434-015-4869-5 [7] TAKENAKA Y, OYA R, KITAMIURA T, et al. Prognostic role of neutrophil-to-lymphocyte ratio in head and neck cancer: a meta-analysis[J]. Head Neck, 2018, 40(3): 647-655. doi: 10.1002/hed.24986 [8] XIE X, LUO K J, HU Y, et al. Prognostic value of preoperative platelet-lymphocyte and neutrophil-lymphocyte ratio in patients undergoing surgery for esophageal squamous cell cancer[J]. Dis Esophagus, 2016, 29(1): 79-85. doi: 10.1111/dote.12296 [9] 王桂峰, 崔珍, 万强琨, 等. 老年食管鳞癌根治性同步放化疗后替吉奥辅助化疗的疗效观察与预后因素分析[J]. 中华全科医学, 2021, 19(3): 379-382, 453. doi: 10.16766/j.cnki.issn.1674-4152.001815WANG G F, CUI Z, WAN Q K, et al. Observation of curative effect and analysis of prognostic factors of S-1 adjuvant chemotherapy after radical concurrent chemoradiotherapy for esophageal squamous cell carcinoma in the elderly[J]. Chinese Journal of General Practice, 2021, 19(3): 379-382, 453. doi: 10.16766/j.cnki.issn.1674-4152.001815 [10] SINGH R, MISHRA M K, AGGRRWAL H. Inflammation, immunity, and cancer[J]. Mediators Inflamm, 2017, 2017(602): 7305. [11] ZHOU X L, ZHU W G, ZHU Z J, et al. Lymphopenia in esophageal squamous cell carcinoma: relationship to malnutrition, various disease parameters, and response to concurrent chemoradiotherapy[J]. Oncologist, 2019, 24(8): 677-686. doi: 10.1634/theoncologist.2018-0723 [12] HIRAHARA N, MATSUBARA T, MIZOTA Y, et al. Prognostic value of preoperative inflammatory response biomarkers in patients with esophageal cancer who undergo a curative thoracoscopic esophagectomy[J]. BMC Surg, 2016, 16(1): 66. doi: 10.1186/s12893-016-0179-5 [13] HAN L H, JIA Y B, SONG Q X, et al. Prognostic significance of preoperative lymphocyte-monocyte ratio in patients with resectable esophageal squamous cell carcinoma[J]. Asian Pac J cancer Prev, 2015, 16(6): 2245-2250. doi: 10.7314/APJCP.2015.16.6.2245 [14] LI K J, XIA X F, SU M, et al. Predictive value of lymphocyte-to-monocyte ratio (LMR) and neutrophil-to-lymphocyte ratio (NLR) in patients with oesophageal cancer undergoing concurrent chemoradiotherapy[J]. BMC Cancer, 2019, 19(1): 1004. doi: 10.1186/s12885-019-6157-4 [15] HU G, LIU G, MA J Y, et al. Lymphocyte-to-monocyte ratio in esophageal squamous cell carcinoma prognosis[J]. Clin Chim Acta, 2018, 486: 44-48. doi: 10.1016/j.cca.2018.07.029 -




 下载:
下载: